„Hilfe: Mein Darm ist undicht“ – Das Leaky Gut Syndrom
Im heutigen Artikel geht es um das „Leaky Gut Syndrom (LGS)“. Wir werden euch einen Überblick über das Leaky Gut Syndrom geben, über mögliche Ursachen, assoziierte Krankheitsbilder, Symptome und Behandlungsoptionen. Also, legen wir los!
Einleitung/Begrifflichkeiten/Ausflug in die med. Studiendatenbank PUBMED
Was ist eigentlich ein Leaky Gut Syndrom? Der Begriff LGS bezieht sich auf die sogenannte „Darmbarriere“. Die meisten klassisch tätigen Ärzte sind mit diesem Begriff nicht vertraut. Wenn Betroffene berichten, dass bei Ihnen eine erhöhte Darmenpermeabilität bzw. eine LGS vorliegt, werden diese meist nicht wahrgenommen bzw. nicht ernst genommen. Ebenso wird oft ein LGS aus med. Pseudokonstrukt von Komplementärmedizinern abgetan. Es wird behauptet, dass dies wissenschaftlich nicht belegt sei, dass ein LGS ein Problem darstellt. Diesen Aussagen kann ich hier ganz klar entgegentreten und sagen, das stimmt so nicht. Es sind sicherlich noch viele Fragen offen, aber ein LGS stellt definitiv ein Problem für den Betroffenen dar.
Man erkennt dies sehr schnell, wenn man sich schlau macht und in der renommierten medizinischen Datenbanksammlung PUBMED den Begriff „Leaky Gut“ eingibt: 95 wissenschaftliche Publikationen (https://pubmed.ncbi.nlm.nih.gov/?term=leaky+gut). Diese setzen sich vor allem mit dem Zusammenhang einer gestörten Darmbarriere und der Entstehung von Autoimmunerkrankungen, welcher nicht von der Hand zu weisen ist, und weiteren unglaublich wichtigen Themen auseinander, die immer stärker in den Fokus der aktuellen medizinischen Forschung und Diskussion rücken. Klinische Berichte deuten darauf hin, dass LGS zu Autoimmunkrankheiten wie Typ-1-Diabetes, Multipler Sklerose, rheumatoider Arthritis und Zöliakie beiträgt (1).
Ich verwende meist nicht den Begriff LGS, sondern den Begriff gestörte intestinale Barrierefunktion oder erhöhte Darmpermeabilität. Diese sind im Endeffekt als Synonyme zum Begriff des LGS zu verstehen. Gibt man dem Begriff intestinale Barrierefunktion in PUBMED ein, erhält man 2355 Publikationen (https://pubmed.ncbi.nlm.nih.gov/?term=intestinal+barrier). Gibt man den Begriff intestinale Permeabilität ein erhält man 2054 Publikationen: (https://pubmed.ncbi.nlm.nih.gov/?term=intestinal+permeability).
Persönliche Anmerkung von mir
Aufgrund der vorliegenden Literatur sollte jeden auch damit nicht vertrauten Mediziner bzw. Heilkundler klar sein, dass eine gesteigerte Darmpermeabilität etwas mit der Gesundheit und gegebenenfalls der Entstehung von Krankheiten, sofern eine Störung der Darmpermeabilität vorliegt, zu tun haben könnte.
Natürlich ist dieses Themengebiet aktuell Gegenstand der Forschung und es sind viele offene Fragen vorhanden. Jedoch existieren in der Ganzheitlichen Medizin bzw. Komplementärmedizin seit Jahren etablierte Konzepte zur erfolgreichen Therapie eines Leaky Gut Syndroms und es wird akzeptiert, dass dieser Zustand behoben werden sollte. Zu dieser Erkenntnis sollte schlussendlich jeder Heilberufler, der primär am Wohl seiner Patienten interessiert ist, kommen und sich Behandlungskonzepte aus anderen Bereichen der Medizin zumindest ansehen und bei Erfolg mit Respekt zur Kenntnis nehmen. Ich bin ein gut ausgebildeter Schulmediziner, Internist und Gastroenterologie und habe nicht umsonst dieses Themengebiet für mich erschlossen und nutze es erfolgreich zum Wohle meiner Patienten.
In der klassischen Schulmedizin existiert aktuell hier kein gangbarer Weg und kein Konzept, um solche Störungen, welche endoskopisch und mit den aktuellen Methoden der Schulmedizin gar nicht detektierbar sind, Herr zu werden. Und dies wird sich vermutlich auf kurze Sicht nicht ändern.
TIPP: Kostenloser Online „Leber & Galle Kongress“ vom 19. bis 28. Juli 2024
Erhalte umfassendes Wissen zur Leber und Gallenblase und verstehe, warum diese Organe so wichtig für deine Gesundheit sind.
Entdecke effektive Leberentgiftungs-methoden und wie du deine Leber auf natürliche Weise entlasten und unterstützen kannst.
* externer Link zu Medumio

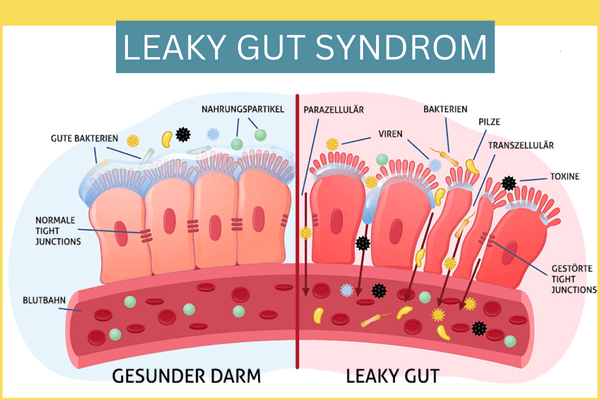
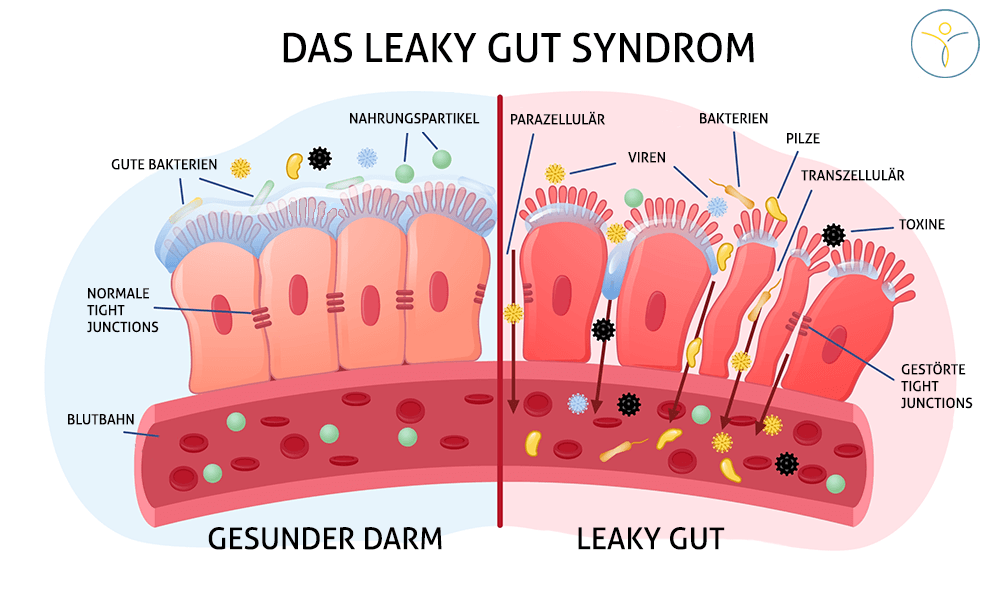
Was ist die Darmbarriere und was passiert bei einem Leaky Gut Syndrom?
Der Darm muss sich aufgrund seiner großen Oberfläche gut vor möglichen Aggressoren schützen (z.B. vor krankmachenden Mikroorganismen). Dafür dient eine intakte Darmbarriere, welche sich aus unterschiedlichen Bestandteilen bzw. Schichten zusammensetzt. Von außen nach innen setzt sich diese aus der Darmflora (dem sog. Darmmikrobiom, aus Billionen von Mikroorganismen bestehend), der Schleimschicht (Mukusschicht), den Darmwandzellen (histologisch ein einschichtiges Zylinderepithel) und dem darunterliegenden Immunsystem des Darms (PS: im Darm sitzen ca. 2/3 des gesamten Immunsystems = MALT = Mukosa-assoziiertes lympathisches Gewebe) zusammen.
Jede Schicht hat Ihre eigenen wichtigen Aufgaben in der Aufrechterhaltung einer intakten Darmbarriere z.B. Abwehr von krankmachenden Mikroorganismen und der Verhinderung Ihrer Andockung und Ihres Eindringens in die Darmschleimhaut. Auf der Ebene der Epithelzellen werden diese durch interzelluläre Verbindungen zusammengehalten. Diese werden in Tight Junctions, Adherens Junctions und Desmosome unterteilt, welche zusammen den sog. „apikalen Junktionskomplex“ bilden.
Bei einem Leaky Gut Syndrom kommt es zu einer Störung der Tight Junctions und zu einer erhöhten Darmpermeabilität, sodass Antigene in die Schleimhaut eindringen können und eine Immunreaktion des dort liegenden intestinalen Immunsystems auslösen können. Die Tight Junctions werden z.B. durch Zonulin geschwächt, welches zu deren Auflösung beiträgt (mehr davon im Folgenden).
Wann tritt ein Leaky Gut Syndrom auf?
Bei verschiedenen Krankheiten ist das Auftreten eines LGS gut dokumentiert. Hierzu zählen entzündliche oder ulzerierende Krankheiten des Darmtrakts z.B. bei Erkrankungen wie den chronisch entzündlichen Darmerkrankungen. Ebenso tritt es bei Patienten mit Zöliakie und Glutensensitivität auf, bei Darminfektionen und bei HIV Infektion bzw. AIDS. Ebenso wurde eine abnorme Darmpermeabilität beim Reizdarmsyndrom beschrieben (2).
(Lesen Sie hierzu auch: Was ist das Reizdarmsyndrom?)
Von entscheidender Bedeutung für eine intakte Darmbarriere sind unter anderem auch eine ausgewogene, gesunde Ernährung, die Meidung von Noxen (Alkohol, ggf. Nahrungsmittelzusätze wie E-Stoffe, gewisse Medikamente wie die Gruppe der nichtsteroidalen Antiphlogistika) und eine Verminderung des Stresslevels.
Ebenso können unerkannte Entzündungsherde im Körper z.B. im Mund-Kiefer-Bereich die Darmbarriere schwächen, da proentzündliche Botenstoffe des Immunsystems (= Zytokine) wie z.B. TNF-alpha oder Interleukin 8 die Darmbarriere bekanntlich schwächen können. Somit kann ein LGS auch durch Darm-ferne Pathologien getriggert werden. Dagegen können entzündungshemmende Zytokine wie TGF-beta oder Interleukin 10 die Darmbarriere stärken. Hierdurch sieht man, dass das Zytokinmilieu auch von entscheidender Bedeutung ist.
Wie gehen wir in unserer Praxis vor?
In unsere Anamnese bzw. Diagnostik ergründen wir Vieles. Unter anderem die vorliegenden Zahnmaterialien, testen auf mögliche Entzündungsherde im Körper, auf mögliche Nahrungsmittelallergien und -zusätze, auf eine bakterielle Fehlbesiedelung des Dünndarms, auf chronische Infektionserkrankungen (schulmedizinisch hat man fast nur die akuten Phasen von Infektionserkrankungen im Focus) im Magen-Darm-Bereich (z.B. Yersinien, Campylobacter jejuni, Darmparasitosen uvm.), auf eine mögliche Histaminabbaustörung und eine Mastzellerkrankung (MCAD). Wir führen eine ausführliche Anamnese, inklusive einer Ernährungs- und Sozialanamnese durch und sichten alle Vorbefunde inklusive vorliegender gastroenterologischer Fachdiagnostik (z.B. Atemteste, Endoskopien, Stuhluntersuchungen).
Weiterführende Informationen zur bakteriellen Fehlbesiedlung des Dünndarms und zur Histaminabbaustörung / Mastzellerkrankung (MCAD)
Wie diagnostizieren wir ein Leaky Gut Syndrom und welche Parameter deuten darauf hin?
Es gibt aktuell noch keinen praktikablen Goldstandard in der medizinischen Diagnostik, der von allem Ärzten anerkannt wird. Dies ist auch ein großes Problem, weil dies häufig einen Streitpunkt mit klassisch schulmedizinischen Kollegen darstellt, sodass ich mir hier persönlich baldigst eine praktikable Lösung von Seiten der Wissenschaft und der Fachgesellschaften wünschen würde. Vor allem Zonulin scheint ein vielversprechender Parameter für die Diagnostik eines LGS zu sein.
Die in der Forschung bzw. Studien angewandten Verfahren (Laktulose/Mannitol- oder Laktulose-Rhamnose-Tests) sind im Praxisalltag nicht praktikabel.
In der sogenannten Ganzheitlichen Medizin wird wie folgt vorgegangen: es werden Stuhl- und Blutparameter bestimmt. Beides zu bestimmen ist sinnvoll, da es vorkommt, dass einige Werte nur im Stuhl oder Blut positiv sind. Im Blut bestimmen wir iFABP und Zonulin. Im Stuhl bestimmen wir Zonulin und Alpha-1 Antitrypsin. Weitere Informationen zu den Parametern finden Sie hier: https://www.imd-berlin.de/spezielle-kompetenzen/leaky-gut
Ein Ausflug in die Literatur und Forschung für Interessierte bzgl. Zonulin
Ich möchte hier nochmal kurz genauer auf Zonulin eingehen, da dieser Parameter sehr spannend ist.
Ich zitiere hier aus einem interessanten Paper, welches ich vor kurzem las (1):
„Zonulin ist in der Lage die Tight junctions reversibel zu öffnen und dadurch eine LGS zu triggern. Die Ausschüttung von Zonulin kann u.a. durch pathogene Bakterien, einige Nahrungsmittelantigene, aber insbesondere durch die Weizenbestandteile Gluten und Gliadin sowie durch proentzündliche Zytokine induziert werden.„
Experimente an Mäusen zeigen, dass eine Überexpression von Zonulin an der Pathogenese chronischer Entzündungskrankheiten, einschließlich entzündlicher Darmerkrankungen und Autoimmunkrankheiten beteiligt ist. Auch waren die Serumkonzentrationen von Zonulin bei Patienten mit Multipler Sklerose, ankylosierender Spondylitis (Morbus Bechterew), rheumatoider Arthritis und Typ-1-Diabetes im Vergleich zu den Konzentrationen bei gesunden Freiwilligen signifikant erhöht.
In klinischen Studien am Menschen verbesserte Larazotidacetat (Anmerkung: Larazotidacetat ist ein Zonulin Antagonis/Gegenspieler) auch die Symptome bei Patienten mit Zöliakie.
Zusammengenommen unterstützen diese Beobachtungen die Bedeutung von Zonulin als Biomarker für die Durchlässigkeit des Darms und ein vielversprechendes therapeutisches Ziel für LGS-assoziierte Autoimmunkrankheiten.
Laufende Studien zu Larazotidacetat finden Sie hier, eine äußerst spannende Substanz: https://pubmed.ncbi.nlm.nih.gov/?term=Larazotidacetat
Auch verbesserte die Gabe von Larazotidacetat das sog. Multisystemische Entzündungssyndrom bei Kindern (MIS-C) als unterstützende Therapie zur Standardtherapie signifikant (3). Das MIS-C, welches hier nach einer SARS-COV 2 Infektion auftrat, besserte sich durch eine Stabilisierung der Darmbarriere. Anmerkung von mir: Meiner Meinung nach ist hier zu sehen, dass Zonulin bzw. ein LGS eine systemische Entzündung triggern kann. Dies ist auch nachvollziehbar, da 2/3 vom Immunsystem im Darm liegen.
YouTube-Video zum Leaky Gut Syndrom
Das Video wird nach dem Klick auf Abspielen von YouTube geladen und wiedergegeben. Dafür baut Ihr Browser eine direkte Verbindung zu den Servern von YouTube auf. Es gilt die Datenschutzerklärung von Google.
Die Symptome des Leaky Gut Syndroms
Ein LGS ist eigentlich keine Erkrankung, sondern ein Zustand der Darmbarriere, welcher mit verschiedenen Erkrankungen assoziiert ist. Nach diesen Erkrankungen muss man suchen, diese behandeln und dann dadurch die Darmbarriere optimieren. Natürlich kann man dies durch verschiedene Substanzen unterstützen, welche zu einer Regeneration der Darmschleimhaut führen (mehr dazu unter Behandlungsmöglichkeiten).
Mögliche Beschwerden, welche bei einem LGS auftreten können, sind:
- Verdauungsprobleme wie Blähungen, Durchfall oder Verstopfung
- Müdigkeit und Energiemangel
- Nahrungsmittelunverträglichkeiten
- Hautprobleme wie Akne oder Ekzeme
- Gelenkschmerzen und Entzündungen
- Gedächtnisprobleme und Konzentrationsschwierigkeiten
- Verstärkte Neigung zu Autoimmunerkrankungen und
- entzündlichen Erkrankungen
Behandlungsmöglichkeiten Leaky Gut Syndrom
Wir suchen die zugrunde liegende Erkrankungen und therapieren diese kausal. Ein LGS kann viele Ursachen haben, man sollte beim Vorliegen eines LGS anfangen, zu suchen.
Als Beispiel aus der Praxis sei hier eine LGS bei einer bakterielle Fehlbesiedelung des Dünndarms (SIBO) aufgeführt. Ebenso lag ein Lamblienbefall des Dünndarms vor. Hier therapieren wir kausal die Lamblieninfektion durch eine Kombination aus Schulmedizin und natürlichen Substanzen.
Parallel dazu führen wir eine Schleimhautstabilisierungsphase, eine Eliminationsphase von krankmachenden Mikroorganismen und eine Aufbauphase der Darmflora mit naturlichen Substanzen durch.
Begleitet wird dies von einer Ernährungsintervention. Diese setzt sich zusammen aus einem kompletten und strengsten Verzicht auf Milchprodukte jeglicher Art und Gluten für mind. 3-4 Monate, da diese Nahrungsmittel häufig Trigger für eine LGS sind. Aufgrund der SIBO wird eine FODMAP arme Ernährung für 6 Wochen durchgeführt, dies führt bei vielen chronischen Darmbeschwerden zu einer Besserung der Klinik (Lesen Sie hierzu auch: SIBO Ernährungsplan). Nach 10-12 Wochen erfolgt eine Kontrolle der Laborparameter, welche zuvor patholog. verändert waren und eine Wiedervorstellung.
Einzelsubstanzen und deren Wirkung
Es folgen einige Substanzen, welche in der medizinischen Literatur aufgeführt sind und sich anhand von Untersuchungen an Tieren (vor allem Mäusen) oder auch Menschen, nachweislich positiv auf die Darmpermeabilität ausgewirkt haben. Man muss natürlich auch immer die Darmflora, das intestinale Mikrobiom (Viren, Bakterien, Parasiten und Pilze) und das intestinale Immunsystem bei der Therapie mitberücksichtigen. Wir fokussieren uns im Folgenden auf die Wirkung der Substanzen im Bezug auf die Darmpermeabilität.
Glutamin:
Glutamin ist eine Aminosäure und sehr wichtig sind für die Darmschleimhaut. Sie wird auch als „essentielle Aminosäure des Darms“ bezeichnet, weil Sie für den Darm so wichtig ist, obwohl Sie laut Definition zu den nichtessentiellen Aminosäuren gezählt wird. Sie trägt zur Regeneration der Darmschleimhaut bei. Diese wird auch in der Schulmedizin verwendet, falls ein Patient rein über die Vene ernährt wird, damit die Darmbarriere intakt bleibt. Ebenso habe ich bei Patienten, die eine Chemotherapie erhalten hatten und davon Durchfall bekamen, sehr positive Erfahrungen durch die hochdosierte Gabe von Glutamin gemacht in Bezug auf eine Verkürzung der Durchfalldauer.
Kurzkettige Fettsäuren:
Kurzkettige Fettsäuren, z.B. Butyrat, wirken sich sehr positiv auf die Darmbarriere aus (4). Diese werden unter anderem von Faecalibacterium prausnitzii, einen im Darm vorkommenden Keim, produziert. F. prausnitzii produziert ein mikrobielles entzündungshemmendes Molekül, welches die Integrität der Tight Junctions festigt. Auch bei Patienten mit Morbus Chron, bei welchen der Keim häufig vermindert im Mikrobiom vorkommt, scheint sich F. prausnitzii durch antientzündliche Eigenschaften positiv auf die Entzündung im Darm auszuwirken und könnte in der zukünftigen Therapie als unterstützende Massnahme eine wichtige Rolle spielen (5).
Probiotika:
Einige Darmbakterien, welche auch als Probiotika zugeführt werden, scheinen sich, neben anderen positiven Effekten, optimierend auf die Darmbarriere auszuwirken. Als Beispiel sei hier der im Darm lebende Lactobacillus spp. aufgeführt, welcher einzigartige Hydroxyfettsäuren wie 10-Hydroxy-cis-12-octadecensäure produziert. Im Mausexperiment führte die Gabe zu einer Stärkung der Epithelbarriere und einer Stärkung des intestinalen Immunsystems (über eine gesteigert sIgA-Sekretion) (6,7,8).
Leaky Gut Syndrom – Fazit
Das Leaky Gut Syndrom ist ein ernstzunehmender und zu therapierender Zustand der Darmschleimhaut, welcher manifesten schulmedizinischen Erkrankungen (auch Jahre) vorausgehen kann. Ein LGS sollte für jeden Therapeut ein Warnsignal darstellen, tätig zu werden, um Schlimmeres abzuwenden. Eine Leaky Gut Syndrom kann sowohl als Folge von systemischen Erkrankungen als auch als möglicher Auslöser fungieren und ein Zusammenhang mit Autoimmunerkrankungen und chronisch entzündlichen Erkrankungen ist nicht mehr zu bestreiten.
Viele Fragen sind sicherlich noch offen, die Diagnostik nicht abschließend geklärt und eine Definition noch klarer und enger vorzunehmen. Jedoch zeigen aktuelle Studien und Untersuchungen die Relevanz der Darmbarriere, nicht zuletzt die vielversprechenden Ergebnisse durch die Gabe des Zonulin Rezeptorantagonisten Larazotidacetat.
Wir können uns hier sicher auf viele zukünftige Erkenntnisse aus der Forschung freuen, da die Themengebiet Mikrobiom und Darmbarriere intensiv beforscht werden.
Literatur:
1. Kinashi Y, Hase K. Partners in Leaky Gut Syndrome: Intestinal Dysbiosis and Autoimmunity. Front Immunol. 2021;12:673708. Published 2021 Apr 22. doi:10.3389/fimmu.2021.673708.
2. Camilleri M. Leaky gut: mechanisms, measurement and clinical implications in humans. Gut. 2019;68(8):1516-1526. doi:10.1136/gutjnl-2019-318427.
3. Yonker LM, Swank Z, Gilboa T, et al. Zonulin Antagonist, Larazotide (AT1001), As an Adjuvant Treatment for Multisystem Inflammatory Syndrome in Children: A Case Series. Crit Care Explor. 2022;10(2):e0641. Published 2022 Feb 18. doi:10.1097/CCE.0000000000000641
4. Kelly CJ, Zheng L, Campbell EL, Saeedi B, Scholz CC, Bayless AJ, et al.Crosstalk Between Microbiota-Derived Short-Chain Fatty Acids and Intestinal Epithelial HIF Augments Tissue Barrier Function. Cell Host. Microbe (2015) 17:662–71. doi: 10.1016/j.chom.2015.03.005
5. Sokol H, Pigneur B, Watterlot L, et al. Faecalibacterium prausnitzii is an anti-inflammatory commensal bacterium identified by gut microbiota analysis of Crohn disease patients. Proc Natl Acad Sci U S A. 2008;105(43):16731-16736. doi:10.1073/pnas.0804812105
6. Kishino S, Takeuchi M, Park SB, Hirata A, Kitamura N, Kunisawa J, et al. Polyunsaturated Fatty Acid Saturation by Gut Lactic Acid Bacteria Affecting Host Lipid Composition. Proc Natl Acad Sci USA (2013) 110:17808–13. doi: 10.1073/pnas.1312937110 74.
7. Miyamoto J, Mizukure T, Park SB, Kishino S, Kimura I, Hirano K, et al. A Gut Microbial Metabolite of Linoleic Acid, 10-hydroxy-cis-12-octadecenoic Acid, Ameliorates Intestinal Epithelial Barrier Impairment Partially Via GPR40-MEK-ERK Pathway. J Biol Chem (2015) 290:2902–18. doi: 10.1074/ jbc.M114.610733 75.
8. Kaikiri H, Miyamoto J, Kawakami T, Park SB, Kitamura N, Kishino S, et al. Supplemental Feeding of a Gut Microbial Metabolite of Linoleic Acid, 10- hydroxy-cis-12-octadecenoic Acid, Alleviates Spontaneous Atopic Dermatitis and Modulates Intestinal Microbiota in NC/nga Mice. Int J Food Sci Nutr (2017) 68:941–51. doi: 10.1080/09637486.2017.1318116

